Was sind FDA-Warnbriefe?

Wie in diesem Blog erläutert, stellt die FDA jedes Jahr Hunderte von Warnschreiben zusammen mit Inspektionen von Produktionsanlagen aus. Sie sollten die Warnschreiben ernst nehmen, denn sie sind ein Vorbote für ein schlimmeres Versagen. Sie sollten stets angemessene Korrektur- und Vorbeugungsmaßnahmen ergreifen und eine umfassende Lückenanalyse auf der Grundlage der genannten Anforderungen durchführen, um die Anforderungen vollständig zu erfüllen.Die Reaktion auf USFDA-Warnschreiben ist wichtig.
FDA-Warnschreiben folgen in der Regel auf Inspektionen, bei denen Abweichungen oder Verstöße gegen Vorschriften, z. B. in Bezug auf die Datenintegrität, festgestellt werden. Während der Inspektionen dokumentieren die Prüfer diese Abweichungen mit dem Formular 483. Die Formulare 483 und die FDA-Warnschreiben sind zwar unterschiedlich, aber das Warnschreiben folgt oft als nächster Schritt im Regulierungsprozess.
Das FDA-Warnschreiben beschreibt den Verstoß und das potenzielle Problem, gefolgt von der Angabe, welche Beweise der Hersteller vorlegen muss, um die angesprochenen Bedenken zu dokumentieren.
Wenn ein Hersteller in erheblichem Maße gegen FDA-Vorschriften verstößt, erhält er ein Warnschreiben der FDA, in dem der Verstoß beschrieben wird, z. B. schlechte Herstellungspraktiken oder ungenaue Produktangaben. In dem Schreiben wird eine Korrektur innerhalb eines bestimmten Zeitrahmens gefordert. Die FDA überwacht die Korrekturmaßnahmen des Unternehmens auf ihre Angemessenheit. Nachfolgende Interaktionen zwischen der FDA und dem Empfänger können sich auf die in dem Schreiben angesprochenen Probleme auswirken. Warnschreiben werden bei schwerwiegenden Verstößen oder unzureichenden Antworten auf FDA 483 ausgestellt und können zu behördlichen Maßnahmen führen, wenn sie nicht wirksam gelöst werden.
Beispiel: https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters
Was ist das FDA-Formular 483?

Das FDA-Formular 483, offiziell bekannt als „Notice of Inspectional Observations“ und allgemein als „483“ bezeichnet, wird am Ende einer Vor-Ort-Inspektion von regulierten Einrichtungen durch den FDA-Ermittler vor Ort ausgestellt, um auf Mängel im Qualitätssystem oder auf Bedingungen zu reagieren, die gegen das Lebensmittel-, Arzneimittel- und Kosmetikgesetz verstoßen.
Die 483 stellt keine Feststellung der FDA über Verstöße dar, sondern dient als Anleitung für Korrekturmaßnahmen, die der Hersteller aufgrund der Inspektion ergreifen muss. Wenn ein Hersteller ein 483-Formular erhält, muss er darauf reagieren, indem er die Bedeutung des Formulars für Arzneimittel versteht und das Problem behebt, um ein Warnschreiben zu vermeiden. Das FDA-Formular 483 dient als Hilfsmittel für Hersteller, um Probleme bei der Einhaltung der Vorschriften zu verstehen und zu beheben, und ist der Ausgangspunkt für die Kommunikation zwischen der FDA und der Einrichtung.
Trends bei USFDA-Warnbriefen verstehen
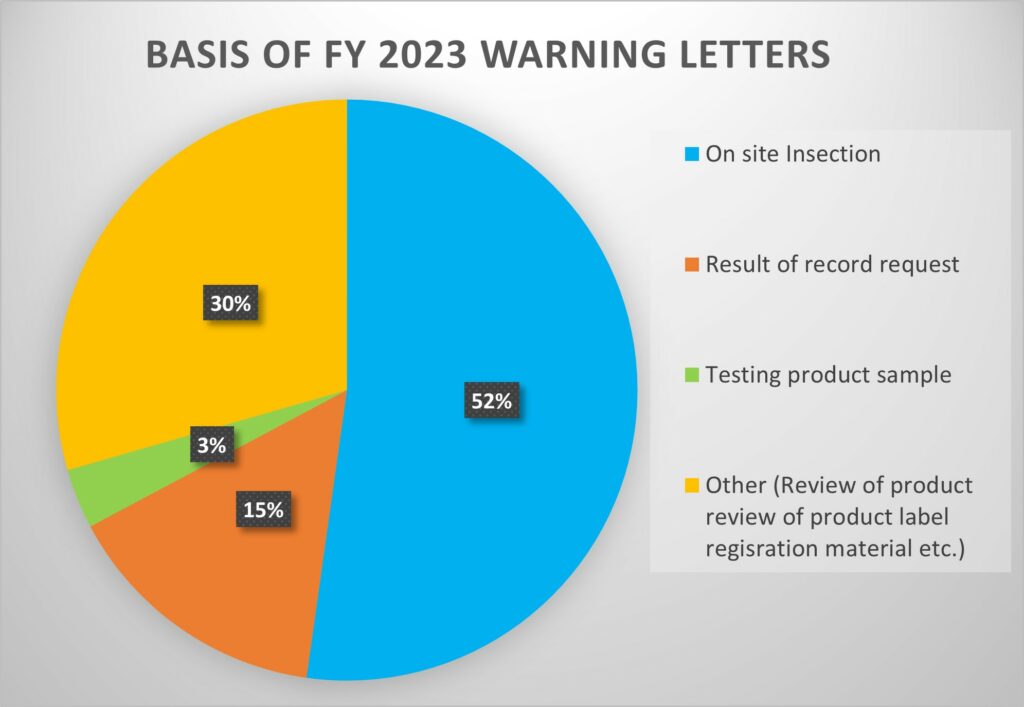
Auf der Grundlage von Daten : : https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/compliance-actions-and-activities/warning-letters
Im Haushaltsjahr 2023 (FY23) hat die US-FDA 180 Warnschreiben an Hersteller von Arzneimitteln und Biologika verschickt. Diese verteilten sich wie folgt,
- 94 basierten auf Inspektionen vor Ort,
- 27 wurden durch Anfragen nach Unterlagen veranlasst,
- 6 stammten aus der Prüfung von Produktproben
- Andere betrafen Produktetiketten, Registrierungsunterlagen und/oder Websites.
Dies bedeutet einen Anstieg im Vergleich zu den 165 Mahnschreiben, die im GJ22 ausgestellt wurden, von denen 74 auf Inspektionen zurückgingen.
Die häufigsten Zitate in FDA-Warnschreiben für das Steuerjahr 2023
Eine Analyse der Vorladungen innerhalb der inspektionsbasierten Warnschreiben ergab die wichtigsten Vorladungen der FDA für das GJ2023. Eine Analyse der Vorwürfe im Rahmen der inspektionsbasierten Warnschreiben ergab die wichtigsten Vorwürfe der FDA für das GJ2023. Als Hersteller können wir nun aus den Fehlern anderer lernen und ein internes Audit planen, um die Bereitschaft der Fabrik zu überprüfen und Lösungen für die FDA-Warnschreiben zu finden und zu besprechen, wie man mit den FDA-Warnschreiben umgehen kann.
- 21 CFR 211.100(a): Dieser Abschnitt wird hervorgehoben, weil es versäumt wurde, angemessene schriftliche Verfahren für die Produktions- und Prozesskontrolle festzulegen.
- 21 CFR 211.22: Dieser Abschnitt wird hervorgehoben, weil die Qualitätskontrolle ihre Verantwortung nicht wahrgenommen hat, um sicherzustellen, dass die hergestellten Arzneimittel den cGMP-Vorschriften entsprechen.
- 21 CFR 211.84: Dieser Abschnitt wird hervorgehoben, weil es versäumt wurde, Komponenten, Arzneimittelverpackungen und Verschlüsse zu testen und zu genehmigen oder zurückzuweisen.) Hier geht es um Prüf- und Zulassungsverfahren, Probenahmekriterien und -verfahren, einschließlich der Reinigung von Behältern und der Vermeidung von Kontaminationen bei Komponenten, Arzneimittelbehältern und Verschlüssen. Probenidentifizierung und -handhabung sowie deren Untersuchungs- und Testanforderungen.
- 21 CFR 211.192: Dieser Abschnitt wird hervorgehoben, weil es versäumt wurde, jede unerklärliche Diskrepanz oder jedes Versagen einer Charge oder eines ihrer Bestandteile, die Spezifikationen zu erfüllen, gründlich zu untersuchen, unabhängig davon, ob die Charge bereits verteilt wurde oder nicht). In diesem Zitat ist die Rede davon, dass die Aufzeichnungen über die Herstellung und Kontrolle von Arzneimitteln, einschließlich der Verpackung und Etikettierung, vor der Freigabe oder dem Vertrieb einer Charge von der Qualitätskontrollstelle überprüft und genehmigt werden müssen.
- 21 C.F.R. 211.165: Dieser Abschnitt wird hervorgehoben, weil die Charge vor der Freigabe für den Vertrieb nicht geprüft wurde. Für jede Charge eines Arzneimittels muss eine angemessene Laborbestimmung der zufriedenstellenden Konformität mit den endgültigen Spezifikationen für das Arzneimittel vorliegen. Jede Charge eines Arzneimittels muss einer Laborprüfung unterzogen werden, um die Konformität mit den endgültigen Spezifikationen sicherzustellen.
Analyse der wichtigsten Feststellungen zur Datenintegrität in FDA-Warnschreiben
Feststellungen zur Datenintegrität werden von der FDA sehr ernst genommen. Mängel können das Vertrauen zwischen der FDA und einem Unternehmen erschüttern, was zu FDA 483s, Warnschreiben, Importwarnungen, einstweiligen Verfügungen und in extremen Fällen dazu führen kann, dass die FDA die Integritätsrichtlinie für Anwendungen anwendet. Es überrascht nicht, dass die FDA bei der Durchsetzung immer aggressiver vorgeht. Ganz oben auf der Liste stand das Thema unvollständige oder fehlende Aufzeichnungen.
- Mangelnde Zugangskontrolle zu IT-Systemen, einschließlich angemessener Verwaltungsrechte und der Verwendung gemeinsam genutzter Konten.
- Das Löschen oder Vernichten von Originalaufzeichnungen zur Guten Herstellungspraxis (GMP) war ebenfalls ein Thema. Es wurde darauf hingewiesen, dass Analytiker Daten in elektronischen Aufzeichnungen löschen und Probenhefte und Prüfprotokolle im Papierkorb finden.
- Es wurde über eine unangemessene manuelle Integration berichtet, bei der Proben ohne Begründung mehrfach bearbeitet wurden und nur ein Datensatz vorhanden war.
- Es wurden Probleme mit Prüfprotokollen beobachtet, da die Systeme keine Prüfprotokolle enthielten, die Prüfprotokolle von den Benutzern deaktiviert wurden und die Prüfprotokolle nicht überprüft wurden, um das Löschen oder die Manipulation von Daten zu erkennen.
- Anmeldung, gemeinsame Nutzung von Passwörtern
- QMS-Excel-Tabellen nicht validiert oder passwortgeschützt
- Keine Sicherungs- und Wiederherstellungsfunktion, fehlende Rückverfolgbarkeit der Personen, die Qualitätsdaten auf Papier aufzeichnen
- Fehlende Original-Qualitätsaufzeichnungen, unvollständige Qualitätsaufzeichnungen
Brauche Hilfe bei Beratung zur FDA-Konformität

Wie man auf 483 Beobachtungen und WARNUNGSBRIEFE reagiert
Die Schritte zur Beantwortung von FDA-Schreiben sind wirklich kritisch und im Gegensatz zu einem FDA-Formular 483 steht bei einem Warning Letter mehr auf dem Spiel. Eine unzureichende Antwort auf ein FDA-Formular 483 kann zu einem Warning Letter führen, aber eine unzureichende Antwort auf ein Warning Letter kann zu schwerwiegenden Durchsetzungsmaßnahmen führen.
Diese Maßnahmen können Ihre Fähigkeit, Produkte zu vermarkten, erheblich beeinträchtigen, einschließlich der Verhinderung des internationalen Marktzugangs, Beschlagnahmungen, einstweilige Verfügungen und möglicher strafrechtlicher Verfolgung. Für ausländische Hersteller kann der Erhalt eines Warning Letter dazu führen, dass sie auf die Import-Hold-Liste gesetzt werden, wodurch die Produkte effektiv vom US-Markt ausgeschlossen werden.
Der Reaktionsplan der FDA auf einen Warning Letter sollte eine konkrete und präzise Antwort auf die im Formular 483 und im Warning Letter geäußerten Beanstandungen geben und Schritte zur Verbesserung der Einhaltung der FDA-Vorschriften enthalten. Nachfolgend finden Sie die wichtigsten Schritte zum Umgang mit FDA-Warnschreiben.
Teilen Sie der FDA per Einschreiben mit, dass Sie beabsichtigen, innerhalb von 15 Arbeitstagen auf das Warnschreiben zu antworten. Dies sollte ein einfaches Schreiben sein, das nur zeigt, dass Sie beabsichtigen, innerhalb der Frist zu antworten.
- Sobald Sie die FDA über Ihre Absicht informiert haben, die Probleme zu lösen, müssen Sie entscheiden, ob Sie die Wiederherstellung selbst in die Hand nehmen oder eine erfahrene dritte Partei um Unterstützung bitten.
- Wenn Sie sicher sind, dass Sie die richtigen Mitarbeiter haben, sollten Sie eine Schlüsselperson für die Leitung des Teams bestimmen. Diese Person muss ein umfassendes Verständnis der genannten Probleme haben und eine klare Vorstellung davon, wie sie zu beheben sind.
- Wenn Sie daran zweifeln, dass Sie die Probleme intern vollständig lösen können, sollten Sie sich an eine erfahrene Drittfirma wenden, die über eine Erfolgsbilanz verfügt.
- Legen Sie eine Liste der Maßnahmen fest, die für jede allgemeine Überschrift und jedes spezifische Beispiel einer FDA-Beobachtung entweder durchgeführt werden oder wurden.
- Nachstehend finden Sie typische Beispiele für Maßnahmen, die als Reaktion auf FDA-Bemerkungen ergriffen werden sollen. Bestimmen Sie, welche dieser Punkte zutreffend und angemessen sind. Führen Sie die Maßnahmen für jede FDA-Beobachtung und jedes Beispiel auf. Beispiele: Auswirkungen auf das Produkt bewerten, Produkt entfernen, Produkt auf Eis legen, Verfahren bereitstellen, Schulungen durchführen, Audits durchführen, Expertenrat berücksichtigen, CAPA eröffnen, Dokumente bereitstellen, Methoden validieren, Prozesse validieren, Systemvalidierung abschließen.
- Legen Sie Ihre Antwort an die FDA in einer leicht verständlichen und übersichtlichen Form vor. Die Antwort sollte folgendes enthalten: Anschreiben – Hauptteil der Antwort – Liste der Anhänge – Tabelle der Leistungen usw.
- Im Anschreiben sollte angegeben werden, wer der Hauptansprechpartner ist und Ihr Antwortschreiben unterzeichnet. Das Anschreiben sollte den Grund für das Schreiben und eine Begriffsdefinition, die Zusage des Managements und/oder Fragen des Warnschreibens, die Verantwortlichkeiten des Managements, die Bitte um ein Treffen mit der FDA bei systemischen Mängeln oder Fragen des Gesundheitsrisikos, die Identifizierung von Streitpunkten, die Einführung von Anlagen und die Zusage für die nächste Aktualisierung der Antwort enthalten.
- Der Hauptteil der Antwort sollte systemische Korrekturen für die zugrundeliegenden Probleme, Korrekturmaßnahmen für bestimmte Fälle, Schritte zur Identifizierung, Untersuchung und Korrektur ähnlicher Probleme, eine Bewertung der Auswirkungen auf die hergestellten Produkte, vorläufige Maßnahmen zur Einhaltung der Vorschriften, realistische Zeitpläne für Korrekturen und Anhänge zur Überprüfung der durchgeführten Maßnahmen enthalten. Geben Sie an, was die FDA in Anhang 2 sehen möchte – Liste der Anhänge
- Für Anhang 3 verwenden Sie eine Tabelle mit der Nummer jeder FDA 483 Beobachtung (oder Warning Letter Beobachtung) und einer kurzen Beschreibung der abgeschlossenen und geplanten Maßnahmen mit Zeitplan. Eine schöne Vorlage für FDA 483/ Warning letter finden Sie auf der sourse green light Guru Website.
Sobald sich die Behörde davon überzeugt hat, dass Ihr Plan angemessen ist, wird Ihnen ein Termin für eine Nachkontrolle und eine Abschlussbesprechung mitgeteilt. Obwohl Sie um ein Treffen mit der FDA bitten können, um Ihren Sanierungsplan zu besprechen, sollten Sie sich nicht darauf verlassen, dass die Aufsichtsbehörden Ihnen Ratschläge erteilen oder aussagekräftige Informationen darüber geben, was Sie tun sollten.
Häufig gestellte Fragen
A: Ein FDA-Formblatt 483 wird am Ende einer Inspektion an die Unternehmensleitung ausgestellt, wenn ein oder mehrere Ermittler Bedingungen festgestellt haben, die nach ihrer Einschätzung Verstöße gegen den Food Drug and Cosmetic (FD&C) Act und damit verbundene Gesetze darstellen könnten. Die FDA-Ermittler sind darin geschult, sicherzustellen, dass jede auf dem FDA-Formular 483 vermerkte Beobachtung klar, spezifisch und signifikant ist. Beobachtungen werden gemacht, wenn die beobachteten Bedingungen oder Praktiken nach dem Urteil des Ermittlers darauf hindeuten, dass ein Lebensmittel, ein Arzneimittel, ein Medizinprodukt oder ein kosmetisches Mittel verfälscht wurde oder unter Bedingungen zubereitet, verpackt oder aufbewahrt wird, durch die es verfälscht oder gesundheitsschädlich werden kann.
A: Mit dem FDA-Formular 483 wird die Unternehmensleitung über beanstandete Zustände informiert. Am Ende einer Inspektion wird das FDA-Formular 483 vorgelegt und mit der Unternehmensleitung besprochen. Die Unternehmen werden ermutigt, auf das FDA-Formular 483 schriftlich mit einem Plan für Abhilfemaßnahmen zu reagieren und diesen Plan dann zügig umzusetzen.
A: Nein, das ist es nicht. Das FDA-Formular 483 ist ein Bericht, der keine Beobachtungen enthält, die zum Zeitpunkt der Inspektion von fragwürdiger oder unbekannter Bedeutung waren. Es kann sein, dass es in dem Unternehmen andere beanstandbare Zustände gibt, die nicht im FDA-Formular 483 aufgeführt sind. Die FDA-Ermittler sind angewiesen, nur das zu vermerken, was sie im Laufe der Inspektion gesehen haben.
Die Unternehmen sind dafür verantwortlich, Abhilfemaßnahmen zu ergreifen, um die angeführten beanstandeten Zustände und alle damit zusammenhängenden nicht angeführten beanstandeten Zustände zu beseitigen, die möglicherweise bestehen.
A: Die FDA-Formulare 483 werden nach Abschluss der Inspektion mit der Unternehmensleitung besprochen. Jede Beobachtung wird vorgelesen und besprochen, so dass ein umfassendes Verständnis der Beobachtungen und ihrer Bedeutung gegeben ist.
A: Das FDA-Formblatt 483 stellt keine endgültige Entscheidung der Behörde darüber dar, ob ein Zustand gegen den FD&C Act oder eine seiner einschlägigen Vorschriften verstößt. Das FDA-Formblatt 483 wird zusammen mit einem schriftlichen Bericht, dem so genannten Establishment Inspection Report, allen vor Ort gesammelten Beweisen oder Unterlagen und allen Antworten des Unternehmens geprüft. Die Agentur prüft alle diese Informationen und entscheidet dann, welche weiteren Maßnahmen zum Schutz der öffentlichen Gesundheit gegebenenfalls erforderlich sind.
Lektionen zum Lernen
- Jeder, der ein FDA-Warnschreiben erhält, muss wissen, dass er extrem verzweifelt ist. Jetzt ist es an der Zeit, all unsere Energie darauf zu verwenden, das Problem an der Wurzel zu packen.
- Warnschreiben und Inspektionsdaten sind von entscheidender Bedeutung für die Identifizierung von Schwerpunktbereichen und Schwachstellen im Qualitätssystem. Angesichts der anhaltenden Konzentration auf GMP-Verstöße und der allgemeinen Zunahme von Vorladungen in der pharmazeutischen Industrie ist die Beachtung von FDA-Warnschreiben unerlässlich. Ihre proaktive Vermeidung gewährleistet nicht nur die Einhaltung der Vorschriften, sondern spart auch Kosten und verhindert potenzielle Misserfolge.
Useful links:
The FDA has provided the following guidance documents on FDA Form 483 and Warning Letters:
FDA Form 483 Frequently Asked Questions
Warning Letters
Inspection Observations
Understanding the Form FDA 483 Process and Timelines
https://www.fda.gov/media/162162/download
Trends : Source https://www.outsourcedpharma.com/doc/trends-in-fda-fy2023-inspection-based-warning-letters-0001
Unveiling GMP Inspections: Key Deficiencies and Guidelines




